Synthèse
La matière et l'esprit
L'atomisme
Dans son acception courante, la notion de matière sert à désigner la réalité constitutive du monde physique, des corps. La physique est, dit-on, la science de la matière — bien que cette catégorie ne fasse pas partie des concepts de la physique. (La physique ne traite pas de la matière comme telle mais de masse, d'énergie, de force...)
D'un point de vue philosophique, la notion de matière sert à désigner un type de réalité distinct de l'esprit d'une part et de la vie d'autre part. Mais que recouvre au juste cette notion? De quoi est faite la matière? Quelles en sont les déterminations? Entre l'objet de l'expérience quotidienne et l'objet de la physique y a-t-il une commune mesure?
L'histoire de l'atomisme illustre bien le fait que ce que l'on entend par matière est très variable et est tributaire de l'histoire de la physique. "La matière est faite d'atomes" disent les atomistes. Mais entre les atomes de Démocrite et Epicure et les atomes des chimistes et des physiciens modernes y a-t-il plus qu'une vague analogie?
L'atome (éthymologiquement "insécable, indivisible) designe traditionnellement le plus petit élément de matière, simple et indécomposable constituant toute réalité. Mais l'atome de la physique atomique n'est ni simple, ni indécomposable, et son lien avec les propriétés observables de la matière est loin d'être direct.
Le tableau ci-dessous retrace schématiquement l'évolution de l'atomisme et met en évidence à quel point ce que nous appellons "matière", loin d'être un donné, est une construction de l'esprit dans l'effort de comprendre la réalité.
Les modèles de l'atome |
|
 |
Modèle de la miniature
Épicure (IVe s. av. J.-C.) Les atomes sont des petites parcelles de matières indivisibles, plus ou moins régulières, en perpétuel mouvement dans le vide et qui s'assemblent au hasard des chocs. Les choses rugueuses sont composées d’atomes rugueux, les choses lisses, d’atomes lisses etc. |
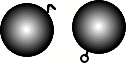 |
Modèle des atomes crochus
Dalton (1808) À la suite de Boyle et de sa conjecture concernant les éléments chimiques, Lavoisier explique la combustion par la notion de réaction entre atomes. Dalton généralise cette conception. Il se représente les atomes comme des petites quantités de matière capables de s'assembler grâce à un système d'oeillets et des crochets. |
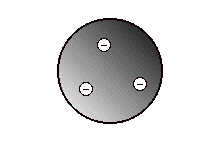 |
Modèle du plum-pudding
Thomson (1906) Après avoir découvert l'électron, Thomson (Prix Nobel en 1906) imagina l'atome comme une sphère impénétrable de charge positive dans laquelle étaient incrustés des électrons négatifs, comme des fruits dans un gâteau. |
 |
Modèle du noyau
Rutherford (1911) Dans ce modèle, l'atome se compose d'un noyau très petit chargé positivement et entouré d'électrons négatifs qui tournent dans le vide autour de lui selon une orbite circulaire. Les électrons peuvent être à n'importe quelle distance du noyau. |
 |
Modèle planétaire
Bohr (1913) C'est le modèle nucléaire à ceci prés que les électrons décrivent des orbites elliptiques et toutes les distances par rapport au noyau ne sont pas possibles : seules celles correspondant à des énergies bien précises peuvent être parcourues. Un électron émet ou absorbe de l'énergie quand il passe d'une orbite à une autre. |
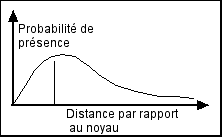 |
Modèle de l’onde-corpuscule
De Broglie, Schrödinger (1927) Selon ce modèle, l'électron a à la fois des propriétés corpusculaires et des propriétés ondulatoires. On ne peut plus le considérer simplement comme une particule en orbite. Tout ce que l'on connaît, c'est la probabilité qu'il se trouve à une certaine distance du noyau représentée par une courbe mathématique. |
Le dualisme onde-particule bouleverse nos intuitions sur la matière et remet en cause le déterminisme rigoureux de la Mécanique newtonienne.